مقاله مروری منتشر شده در مجله ارتباطات طبیعت یک مرور کلی از پیشرفتهای اخیر در مدلهای تراشههای میکروسیال برای بیماریهای عصبی ارائه میدهد.
 مطالعه: نوروپاتوژنز روی تراشه برای بیماریهای عصبی. اعتبار تصویر: luchschenF / Shutterstock
مطالعه: نوروپاتوژنز روی تراشه برای بیماریهای عصبی. اعتبار تصویر: luchschenF / Shutterstock
زمینه
پیشرفتهای اخیر در علم پزشکی، امید به زندگی انسان را به طور قابلتوجهی افزایش داده است، که منجر به خطر تدریجی بیماریزایی عصبی روی تراشهها برای بیماریهای تخریبکننده عصبی، آسیبزایی روی تراشهها برای بیماریهای عصبی در جمعیت سالخورده در سطح جهان شده است. این امر با افزایش همزمان در شیوع بیماری های عصبی مرتبط با سن، از جمله بیماری آلزایمر، بیماری پارکینسون، بیماری هانتینگتون و اسکلروز جانبی آمیوتروفیک همراه است.
بیماری های عصبی عمدتاً بر توانایی های شناختی و رفتاری افراد مسن تأثیر می گذارد. با تجمع پروتئینهای ناکارآمد بهعنوان عامل آغازگر اولیه، این بیماریها برخی از ویژگیهای بیماریزای مشترک، از جمله از دست دادن نورون خاص، گلیوز، التهاب عصبی، استرس اکسیداتیو، اختلال عملکرد میتوکندری و آسیب عروقی اولیه را به اشتراک میگذارند.
علیرغم پیشرفتهای علم پزشکی، توسعه مداخلات تشخیصی و درمانی برای بیماریهای نورودژنراتیو به دلیل پاتوژنز پیچیده چندعاملی که به تدریج پیشرفت میکند، همچنان یک کار چالش برانگیز است.
اندامهای میکروسیال یا ارگانوئیدهای روی تراشهها فرصتی منحصربهفرد برای بازتولید تجربی عناصر حیاتی نواحی متمایز مغز مرتبط با بیماریهای تخریبکننده عصبی فراهم کردهاند. این سیستم های کوچک می توانند برای مطالعه پاتوژنز بیماری، توسعه دارو، غربالگری دارو، و اهداف تحقیقات اولیه زیست پزشکی استفاده شوند.
طراحی تراشه میکروسیال
اتاق کامپنوت، یک بخش تقسیم شده است درونکشتگاهی سیستم، اولین برنامه کاربردی تراشه میکروسیال برای تحقیقات مغز بود. این دستگاه با دو محفظه از هم جدا شده به صورت سیال برای بررسی اثرات فاکتورهای رشد عصبی بر رشد آکسون استفاده می شود. بعدها، دانشمندان چندین سیستم مینیاتوری سلول های عصبی-گلیا، سد خونی مغزی و واحد عصبی عروقی را اختراع کردند.
تراشههای میکروسیال معمولاً شامل دو یا چند محفظه جدا از هم هستند که توسط میکروکانالها، غشاهای متخلخل یا راهنماهای فاز به هم متصل میشوند. این اتصالات برای حفظ فعل و انفعالات مستقیم یا غیرمستقیم بین جمعیت های سلولی همگن یا ناهمگن نگهداری شده در این اتاقک ها مورد نیاز است.
اولین تراشه میکروسیال برای مغز با جداسازی یک سومای عصبی از نوریت های آن با استفاده از میکروکانال ها طراحی شد. این طرح برای مطالعه رشد نوریت جهت دار مورد استفاده قرار گرفت. مدلهای مدار عصبی پیشرفتهتر بعداً با ترکیب اتاقهای متعدد برای زیرجمعیتهای عصبی توسعه یافتند.
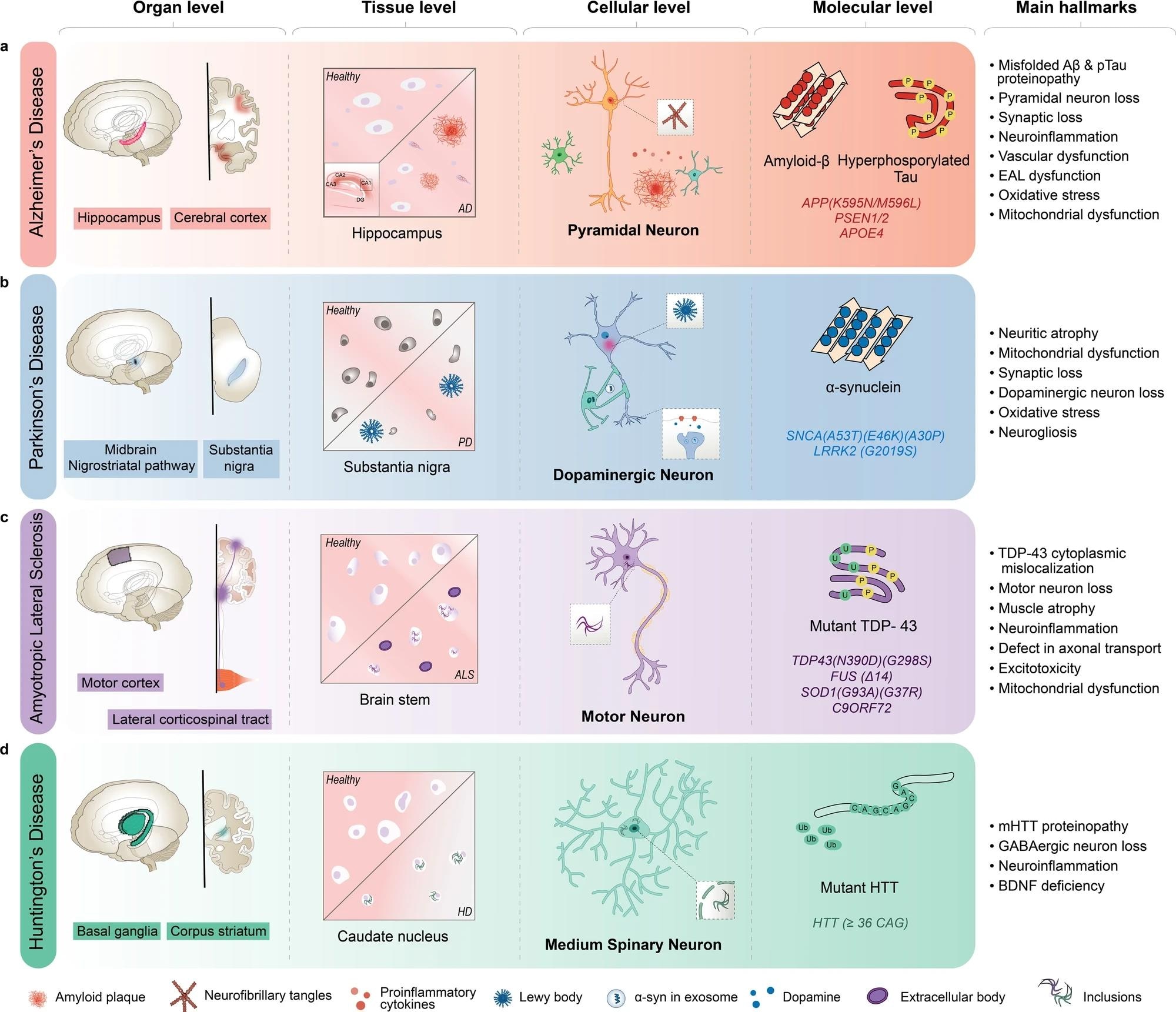 AD با گنجاندن آمیلوئید β (Aβ) و درهم تنیدههای نوروفیبریلاری در نورونهای هرمی، عمدتاً در ناحیه هیپوکامپ و قشر مغز مشخص میشود. ب PD با توده های بدن لوی متشکل از آلفا-سینوکلین تاخورده نادرست و انحطاط نورون های دوپامینرژیک در ناحیه جسم سیاه مغز مشخص می شود. ج ALS با شامل پروتئین جهش یافته به DNA TAR 43 (TDP-43) و سایر پروتئین ها، انحطاط نورون های حرکتی در قشر حرکتی و نخاع و آتروفی عضلانی با پروتئین های ناکارآمد مشخص می شود. د HD با شامل پروتئین هانتینگتین جهش یافته (mHTT) و انحطاط نورون های خاردار متوسط در گانگلیون های پایه و جسم مخطط مغز مشخص می شود. بیماری آلزایمر AD، اسکلروز جانبی آمیوتروفیک ALS، فاکتور نوروتروفیک مشتق از مغز BDNF، مسیر EAL آندوزوم-اتوفاژیک-لیزوزومی، گابا گاما آمینوبوتیریک اسید، بیماری HD هانتینگتون، PSEN presenilin 1، SNCA synuclein alpha.
AD با گنجاندن آمیلوئید β (Aβ) و درهم تنیدههای نوروفیبریلاری در نورونهای هرمی، عمدتاً در ناحیه هیپوکامپ و قشر مغز مشخص میشود. ب PD با توده های بدن لوی متشکل از آلفا-سینوکلین تاخورده نادرست و انحطاط نورون های دوپامینرژیک در ناحیه جسم سیاه مغز مشخص می شود. ج ALS با شامل پروتئین جهش یافته به DNA TAR 43 (TDP-43) و سایر پروتئین ها، انحطاط نورون های حرکتی در قشر حرکتی و نخاع و آتروفی عضلانی با پروتئین های ناکارآمد مشخص می شود. د HD با شامل پروتئین هانتینگتین جهش یافته (mHTT) و انحطاط نورون های خاردار متوسط در گانگلیون های پایه و جسم مخطط مغز مشخص می شود. بیماری آلزایمر AD، اسکلروز جانبی آمیوتروفیک ALS، فاکتور نوروتروفیک مشتق از مغز BDNF، مسیر EAL آندوزوم-اتوفاژیک-لیزوزومی، گابا گاما آمینوبوتیریک اسید، بیماری HD هانتینگتون، PSEN presenilin 1، SNCA synuclein alpha.
تراشه های عصبی فعلی حاوی اتاقک های متعدد با قطرهای مختلف هستند که در هندسه های مختلف قرار گرفته اند. این مدل ها همچنین شامل میکروکانال هایی با اشکال طرح دار و جریان سیال کنترل شده می باشند. این ویژگی ها امکان اتصالات عصبی غیرمستقیم و مستقیم، نامتقارن و متقارن را فراهم می کند.
سیستم های پمپ اضافی و فشار هیدرواستاتیک غیرفعال را می توان برای کنترل جریان سیال در تراشه ها گنجاند. این به ایجاد مدلهای بیماری با اجازه دادن گرادیان مواد شیمیایی با غلظتهای متفاوت در بخشهای سلولی کمک میکند.
غشاهای متخلخل با اندازهها، تعداد و موقعیتهای منافذ مختلف میتوانند روی تراشهها بهعنوان رابط بین محفظهها برای فعال کردن فعل و انفعالات غیرمستقیم به واسطه مواد شیمیایی محلول و تماس فیزیکی مستقیم استفاده شوند. این طرح برای تقلید از سد خونی مغزی بر روی تراشه ها استفاده شده است.
استفاده از تراشه های میکروسیال برای پاتوژنز بیماری های عصبی
تراشه های میکروسیال را می توان برای تکثیر چندین سیستم تشریحی و فیزیولوژیکی، از جمله اتصال عصبی عضلانی، مسیر قشر مغز، ماده سیاه، سد خونی مغزی، سیستم گلیمفاتیک، واحد عصبی عروقی و محور روده-مغزی استفاده کرد.
برای ارائه نشانه های مکانیکی، ساختاری و بیوشیمیایی به سلول ها، ژل ماتریکس خارج سلولی سه بعدی بر روی تراشه ها معرفی شده است که امکان مطالعه مورفولوژی سلولی، الگوهای مهاجرت، انتقال سیگنال و بیان ژن را در زمینه بیماری های تخریب کننده عصبی فراهم می کند.
بیماری آلزایمر روی تراشه
استفاده از تراشههای میکروفلوئیدی در تحقیقات بیماری آلزایمر، بینشهای ارزشمندی را در مورد ویژگیهای بیماریزای متمایز، از جمله تجمع پروتئین آمیلوئید بتا و تاو، اختلال عملکرد میتوکندری و التهاب عصبی ارائه کرده است.
چندین مدل از نورون های روی یک تراشه برای مطالعه انتشار تاو و سمیت آمیلوئید بتا استفاده شده است. با جداسازی سوما و نوریت، نورونهای روی یک تراشه امکان تجسم پروتئینوپاتی را در زمان واقعی فراهم میکنند.
یک تراشه گرادیان با جریان بینابینی برای مطالعه اثر الیگومرهای آمیلوئید بتا بر روی نورون ها استفاده شده است. مهاجرت التهابی میکروگلیا با واسطه سیتوکین به سمت نورون ها و آستروسیت های بیماری آلزایمر با استفاده از یک مدل سه بعدی التهاب عصبی استاتیک روی یک تراشه مشاهده شده است.
سد خونی-مغزی روی یک تراشه برای بازبینی کامل تشکیل پلاک آمیلوئید، تشکیل پیچ و تاب نوروفیبریلاری و افزایش نفوذپذیری سلول های اندوتلیال مغز ایجاد شده است.
نوروسفروئید پویا روی یک تراشه با ترکیب یک پمپ اسمزی که جریانی از آمیلوئید بتا برون زا را برای مطالعه دژنراسیون آکسون و مرگ سلولی ایجاد می کند، توسعه یافته است.
بیماری پارکینسون روی تراشه
مطالعات زیادی با استفاده از بیماری پارکینسون روی یک تراشه برای خلاصه کردن پاتوژنز مرتبط با آلفا سینوکلئین انجام شده است. انتشار آلفا سینوکلئین با کشت همزمان سلول های نوروگلیوما که آلفا سینوکلئین برچسب دار با پروتئین فلورسنت سبز را بیان می کنند مورد مطالعه قرار گرفته است.
یک تراشه گرادیان برای دستکاری بیان آلفا سینوکلئین درون سلولی در مخمرهای به دام افتاده در سیستم با گرادیان گالاکتوز ساخته شده است. نورونهای دوپامینرژیک روی یک تراشه برای خلاصهسازی اختلال عملکرد میتوکندری و دژنراسیون عصبی ناشی از جهشهای مرتبط با بیماری پارکینسون ایجاد شدهاند.
ماده سیاه و تراشههای سد عروقی با کشت مشترک سلولهای بنیادی پرتوان ناشی از سلولهای بنیادی مغز میانی دوپامینرژیک، سلولهای گلیا اولیه و سلولهای اندوتلیال ریز عروقی مغز در اتاقهایی که توسط غشای متخلخل جدا شدهاند، ساخته شدهاند. این مدل برای مطالعه اختلال عملکرد سد خونی مغزی روی تراشه، از دست دادن پیشرونده نورون، التهاب عصبی و آستروگلیوز استفاده شده است.
اسکلروز جانبی آمیوتروفیک روی تراشه ها
استفاده از شیب های کموتاکتیک و حجمی بر روی تراشه های اسکلروز جانبی آمیوتروفیک باعث شکل گیری موفقیت آمیز تعاملات بین نورون های حرکتی جهش یافته FUS و میوتوب های مشتق شده از مزانژیوبلاست از طریق میکروکانال ها شده است.
بسیاری از آسیب شناسی های اسکلروز جانبی آمیوتروفیک با کشت همزمان پروتئین پیوند دهنده به DNA TAR 43 (TDP-43) جهش یافته کروی نورون حرکتی و فیبرهای عضلانی در یک وضعیت سه بعدی بین دو اتاق مجزا بیان شده است.
یک تراشه سه محفظه برای ایجاد فعل و انفعالات متابولیکی بین آستروسیت های جهش یافته با سوپراکسید دیسموتاز و نورون های قشر مغز از طریق میکروکانال ها در شرایط گرادیان گلوتامات ایجاد شده است.
آسیب شناسی عصب کشی عضلانی اسکلروز جانبی آمیوتروفیک با استفاده از یک دستگاه اتصال عصبی-عضلانی باز بخش بندی شده که نورون های حرکتی اپتوژنتیک و آستروسیت های جهش یافته با سوپراکسید دیسموتاز را به عنوان یک کروی کشت می دهد مورد مطالعه قرار گرفته است.
بیماری هانتینگتون روی تراشه
آسیب شناسی های اولیه بیماری پارکینسون با ایجاد اتصالات سیناپسی بین آکسون های قشر مغز و دندریت های مخطط از طریق میکروکانال هایی با طول های مختلف و یک کانال سیناپسی جداگانه مورد مطالعه قرار گرفته است.
Corticostriatal on-a-a-chip برای مطالعه این که چگونه پروتئین هانتینگتین جهش یافته، انتقال آکسونی قشر مغز عوامل نوروتروفیک مشتق شده از مغز را کاهش می دهد تا باعث دژنراسیون نورون مخطط شود، توسعه یافته است.
Source link