_on_a_T-cell_is_binding_to_a_molecule_on_a_cancer_-_Alpha_Tauri_3D_Graphics_M1_dc8762afeaee4937ad644739f274c7a5-620x480.jpg)
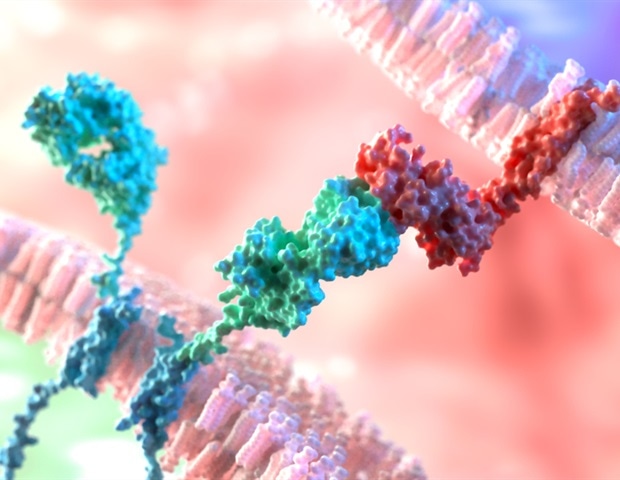
سلولهای T اغلب «قاتل» یا «قاتل» نامیده میشوند، زیرا میتوانند مأموریتهایی را برای شکار باکتریها، ویروسها و سلولهای سرطانی در سراسر بدن سازماندهی و انجام دهند. تحقیقات اخیر نشان داده است که وقتی سلول های T به محیط تومور جامد نفوذ می کنند، انرژی لازم برای مبارزه با سرطان را از دست می دهند.
یک تیم تحقیقاتی به رهبری جسیکا تاکستون، دکترا، MsCR، دانشیار زیست شناسی سلولی و فیزیولوژی و یکی از رهبران برنامه زیست شناسی سلولی سرطان در مرکز جامع سرطان UNC Lineberger، با هدف درک این موضوع که چرا سلول های T انرژی را در تومورها حفظ نمی کنند. آزمایشگاه Thaxton با استفاده از تخصص خود در ایمنی تومور و متابولیسم، به رهبری کیتی هرست، MPH، و 4هفتم الی هانت، دانشجوی سال تحصیلات تکمیلی، دریافت که یک آنزیم متابولیک به نام استیل کوآ کربوکسیلاز (ACC) باعث می شود سلول های T به جای سوزاندن چربی برای انرژی، چربی را ذخیره کنند.
کشف ما یک شکاف طولانی مدت در دانش در مورد اینکه چرا سلول های T در تومورهای جامد به درستی انرژی تولید نمی کنند را پر می کند. ما بیان ACC را در مدلهای سرطان موش مهار کردیم و مشاهده کردیم که سلولهای T میتوانند در تومورهای جامد بسیار بهتر باقی بمانند.
جسیکا تاکستون، دکترا، MsCR، دانشیار زیست شناسی سلولی و فیزیولوژی و یکی از رهبران برنامه زیست شناسی سلولی سرطان در مرکز جامع سرطان UNC Lineberger
یافته های جدید و استراتژی های ایمنی درمانی، که در متابولیسم سلولی، می تواند برای موثرتر کردن چندین نوع درمان با سلول T برای بیماران استفاده شود، که احتمالاً شامل هر دو درمان با سلول T و گیرنده آنتی ژن کایمریک (CAR) می شود.
در زمینه ایمونوتراپی سرطان، مدتهاست که مشخص شده است که سلولهای T قادر به ایجاد انرژی سلولی خود به نام آدنوزین تری فسفات یا ATP در داخل یک تومور جامد نیستند.
در سال 2019، آزمایشگاه Thaxton یک سلول T را با عملکرد ضد تومور بهینه مورد مطالعه قرار داد. در یک نشریه در تحقیقات ایمونولوژی سرطان، هرست و تاکستون از یک صفحه نمایش پروتئومیکس برای شناسایی آنزیم های مرتبط با متابولیسم ضد تومور بهینه این سلول های T استفاده کردند. از طریق این صفحه نمایش، آن دو کشف کردند که بیان ACC ممکن است توانایی سلول های T را برای ساخت ATP در تومورها محدود کند. ACC، یک مولکول کلیدی که در بسیاری از مسیرهای متابولیک درگیر است، سلول ها را از تجزیه چربی و استفاده از آن به عنوان سوخت برای انرژی در میتوکندری مسدود می کند.
تاکستون میگوید: «استیل کوآ کربوکسیلاز میتواند تعادل بین ذخیرهسازی لیپیدها در مقابل تجزیه آنها و تغذیه آنها به چرخه اسید سیتریک برای انرژی برقرار کند». “اگر ACC “روشن” باشد، سلول ها به طور کلی لیپید را ذخیره می کنند. اگر ACC “خاموش” باشد، سلول ها تمایل دارند از لیپید در میتوکندری خود برای ساخت ATP استفاده کنند.”
با استفاده از تخصص هانت در تصویربرداری کانفوکال، تیم تحقیقاتی توانست ذخایر لیپید را در سلول های T جدا شده از انواع مختلف سرطان مشاهده کند. این مشاهدات و همچنین آزمایشهای دیگر، فرضیه تیم را تأیید کردند که سلولهای T به جای تجزیه، لیپیدها را ذخیره میکنند.
سپس تیم Thaxton از حذف ژن با واسطه CRISPR Cas9 استفاده کردند تا ببینند اگر ACC را از تصویر “حذف کنند” چه اتفاقی می افتد. کاهش سریعی در میزان ذخیره چربی در سلولهای T وجود داشت و تیم موفق شد تغییر مکان چربی به میتوکندری را برای استفاده برای تولید انرژی تجسم کند.
تاکستون اکنون این فرضیه را مطرح میکند که سلولهای T ممکن است برای باقی ماندن در تومورهای جامد به “توازن ظریف” لیپیدها نیاز داشته باشند و مقدار معینی از لیپید اختصاص داده شده به کشتن سلولهای سرطانی و سطوح پایین چربی در ذخایر نگهداری شود.
جدیدترین یافتهها میتواند در تقویت درمانهای سلول T با گیرنده آنتی ژن کایمریک (CAR) مفید باشد. این فناوری پیشرفته، سلولهای T را از بیماران سرطانی خارج میکند، آنها را در آزمایشگاه تغییر میدهد تا سلولهای تومور را شکار کنند و سپس سلولها را دوباره برای مبارزه با سرطان بیمار تزریق میکند. داده های اولیه از آزمایشگاه Thaxton نشان می دهد که حتی سلول های T ساخته شده حاوی ذخیره چربی اضافی هستند.
آزمایشگاه شروع به بررسی نمونههای بیمار میکند تا بفهمد چگونه محققان میتوانند کلید متابولیک ACC را مستقیماً در تومورهای بیمار بچرخانند و نیاز به خارج کردن و تزریق مجدد سلولها به بدن را نفی کنند. اما محققان ابتدا باید تعیین کنند که چگونه این می تواند بر سایر جمعیت سلول های ایمنی بدن مانند ماکروفاژها تأثیر بگذارد.
منبع:
مراقبت های بهداشتی دانشگاه کارولینای شمالی
مرجع مجله:
هانت، EG، و همکاران (2024). استیل کوآ کربوکسیلاز مانع استفاده از لیپید سلول های CD8+ در ریزمحیط تومور می شود. متابولیسم سلولی. doi.org/10.1016/j.cmet.2024.02.009
Source link